《畜牧兽医学报》2025年第56卷第10期刊登了山东农业大学动物医学院山东省人畜共患病重点实验室等单位张雲龙, 王靖雷, 朱亚杰, 张明洁, 康澳, 周翔, 魏凯, 曹洪防, 李强, 王勇, 苏峰的文章——“RAA-DETECTOR布鲁氏菌核酸快速检测方法的建立及应用”,该文由国家重点研发计划(2023YFF1000900);山东省现代农业产业技术体系建设经费(SDAIT-10-05;SDAIT-10-015)资助。该研究的创新点:1)技术首创:首次建立RAA-CRISPR/Cas双系统(AsCas12a与LwaCas13a)检测布鲁氏菌,填补RAA结合DETECTOR技术的应用空白。2)性能突破:实现40 min快速检测,灵敏度达10 copies·μL-1,与PCR符合率>95%,兼具高速度、高灵敏度与高准确性。3)现场适用:无需专业设备和核酸提取,仅需恒温装置与侧流层析试纸条,真正满足养殖终端现场筛查需求。4)成本优势:RAA试剂成本低于RPA,LwaCas13a体系检测精度更高,为大范围布病监测提供经济可行的技术方案。
导读
布鲁氏菌病(布病)是严重的人畜共患传染病,主要感染牛羊等家畜及人类,导致流产、关节炎等症状。现有诊断方法(病原分离、虎红平板凝集、PCR、ELISA)存在耗时长、假阳性率高、依赖专业人员和设备等局限,不适用于养殖终端现场快速检测。本研究旨在建立不依赖专业设备的RAA-CRISPR/Cas高效快速检测体系,实现临床样本40分钟内完成检测,为布病现场筛查提供便捷手段。
1 材料与方法
1.1 材料
1.1.1 细菌质粒、AsCas12a、LwaCas13a 以布鲁氏菌S2株基因SEQ NO.6构建阳性质粒;AsCas12a和LwaCas13a蛋白表达质粒。
1.1.2 crRNA sgRNA/crRNA由金斯瑞合成;荧光报告分子ssDNA/ssRNA及生物素报告分子由生工生物合成。
1.1.3 主要试剂 LB培养基、TEV蛋白酶、HisPur™ Ni-NTA树脂、RAA试剂盒、Cas12/13检测试剂盒、HiScribe™ T7 RNA合成试剂盒等。
1.1.4 主要仪器 PCR仪、高速冷冻离心机、凝胶成像系统、超净工作台等常规分子生物学设备。
1.2 方法
1.2.1 引物设计 针对S2株保守序列设计常规PCR引物(PF1/PR1)及RAA等温扩增引物(RAA-F1/R1);LwaCas13a需在PCR引物上游添加T7启动子(PF2/R2)以实现体外转录。
1.2.2 蛋白表达及纯化 重组质粒转化BL21(DE3),诱导表达后通过Ni-NTA亲和层析纯化获得AsCas12a和LwaCas13a蛋白。
1.2.3 crRNA、荧光/生物素报告分子设计 AsCas12a gRNA靶向TTTN PAM后20 bp序列;LwaCas13a crRNA靶向3'端为A/U/C的35 bp序列;报告分子分别为ssDNA(TTATT)和ssRNA(AAAAA),5'端标记FAM,3'端标记BHQ1或生物素。
1.2.4 检测体系验证 分别配置含完整组分及缺少Cas蛋白、crRNA、报告分子或模板的对照体系,验证DETECTOR系统功能。
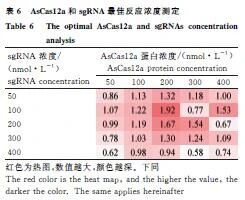
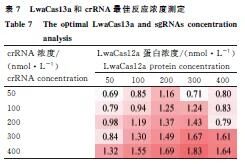
1.2.5 反应条件优化 采用正交试验优化Cas蛋白(50-400 nmol·L-1)与crRNA(50-400 nmol·L-1)最佳浓度。
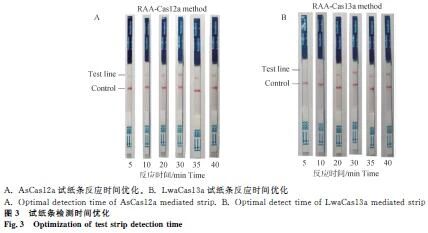
1.2.6 试纸条反应时间 37 °C孵育5、10、20、30、35、40 min后,用侧流层析试纸条判读结果,确定最佳显色时间。
1.2.7 特异性检测 以羊耳缘细胞、李氏杆菌、大肠杆菌、金黄色葡萄球菌基因组为模板,评估体系交叉反应性。
1.2.8 灵敏性检测 对阳性质粒进行十倍梯度稀释(10⁰-10⁻⁹),测定最低检测限(LOD)。
1.2.9 临床样本和拟合性检测 对山东某牛场和羊场68份鼻拭子样本分别进行PCR和RAA-DETECTOR检测,计算符合率。
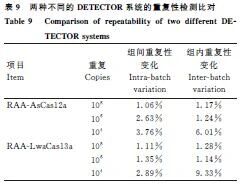
1.2.10 重复性检测 用10⁸、10⁶、10⁴ copies·μL-1质粒模板进行批内(3次)和批间(3批次)重复性检测,计算变异系数(CV)。
2 结果
2.1 重构载体构建及crRNA/sgRNA设计
成功构建阳性质粒并设计靶向序列,RAA引物可有效扩增布鲁氏菌特异性片段(图1)。
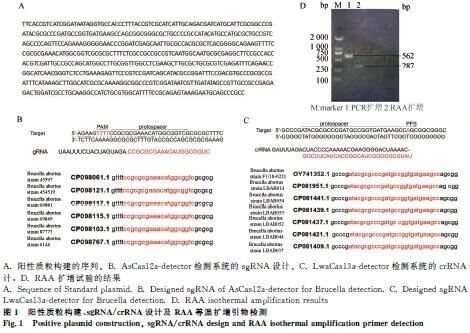
2.2 检测体系验证
只有含完整组分的体系可激活Cas蛋白反式切割活性,产生荧光信号,证实DETECTOR系统工作正常(图2)。

2.3 反应条件优化
AsCas12a体系最佳浓度为蛋白200 nmol·L-1 + sgRNA 200 nmol·L-1;LwaCas13a体系为蛋白300 nmol·L-1 + crRNA 400 nmol·L-1(表6、7)。
2.4 试纸条反应时间优化
AsCas12a与LwaCas13a体系均在20 min呈现明显条带,30 min为最佳判读时间(图3)。
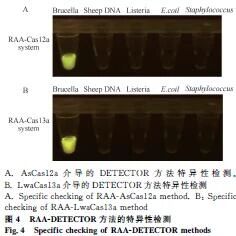
2.5 特异性检测
两种体系仅对布鲁氏菌检测阳性,对羊DNA、李氏杆菌、大肠杆菌、金黄色葡萄球菌均为阴性,特异性良好(图4)。
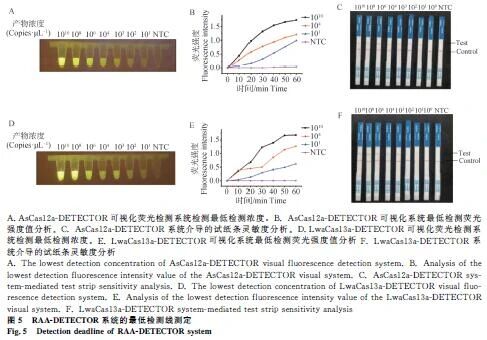
2.6 灵敏性检测
AsCas12a与LwaCas13a体系最低检测限均为10 copies·μL-1,荧光与试纸条结果一致(图5)。
2.7 临床样本与PCR拟合性检测
68份样本中PCR阳性15例(21.43%),AsCas12a-DETECTOR符合率95.7%,LwaCas13a-DETECTOR符合率97.1%(图6,表8)。

2.8 重复性检测
批内CV 1.00%-3.76%,批间CV 1.00%-6.01%,均小于10%,重复性良好(表9)。
3 讨论
本研究首次将RAA等温扩增与CRISPR/Cas12a/Cas13a DETECTOR技术结合用于布鲁氏菌检测。相较于LAMP、RPA等传统等温扩增技术,RAA试剂成本更低,结合CRISPR系统后检测精度与RPA-Cas12a相当(10 copise·μL-1),且无需核酸提取和复杂设备。临床验证显示对鼻拭子样本检测准确性高(>95%),LwaCas13a因靶向RNA且无需PAM序列,在检测精度上略优于AsCas12a。但本研究未针对疫苗株S19缺失片段设计靶点,尚不能区分疫苗株与野毒株,未来需优化以实现鉴别诊断。该方法为布病大规模筛查提供了无需专业设备、40分钟内完成的现场快检方案。
4 结论
成功建立两种RAA-CRISPR/Cas布鲁氏菌核酸快速检测体系:RAA-AsCas12a与RAA-LwaCas13a-DETECTOR。两者均具有特异性强、灵敏度达10 copies·μL-1、与PCR符合率>95%的特点,其中LwaCas13a体系检测精度更高。该方法无需专业设备,可在40分钟内完成检测,适用于临床现场筛查。