
《畜牧兽医学报》2025年第56卷第5期刊登了华中农业大学动物医学院等单位张晓玲, 何兴林, 张梦迪, 李鹏飞, 孙玉梅, 马海龙, 朱红梅, 张梦佳, 李文涛的文章——“猪瘟病毒E2蛋白纳米颗粒的制备及在家兔上的免疫原性分析”,该文由
导读
猪瘟(CSF)是由猪瘟病毒(CSFV)引起的一种高度接触性、致死性传染病,严重危害全球生猪养殖业。传统的C株疫苗虽然在一定程度上控制了猪瘟的暴发和流行,但无法进行疫苗接种和野毒感染的鉴别诊断,给猪瘟的净化带来了困难。因此,开发一种安全、高效且可以进行鉴别诊断的新型猪瘟疫苗具有重要意义。本研究旨在开发一种基于猪瘟病毒E2蛋白的纳米颗粒疫苗,并对其免疫原性进行分析。
使用的病毒为CSFV C株,细胞包括HEK293T、HEK293F和PK15细胞,试验动物为1.5~2.0 kg的雌性日本长耳大白兔。
包括CSFV E2蛋白单克隆抗体、HRP标记山羊抗鼠IgG、FITC标记山羊抗鼠IgG等,佐剂为ISA201,商业化猪瘟E2亚单位疫苗。
通过在线分析跨膜区网站预测CSFV E2蛋白的胞外域,保留1-341 aa部分并进行人源密码子优化。构建了pCAGGS-E2、pFRT-E2-pFc和pCAGGS-SpyTag-E2真核表达质粒,以及pCAGGS-LS-protein A质粒。
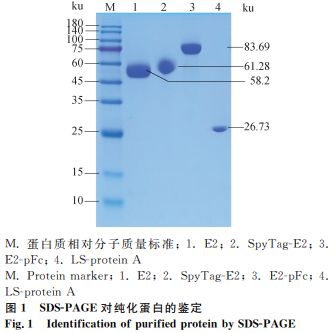
使用HEK293F细胞表达E2、E2-pFc、SpyTag-E2和LS-protein A蛋白,并通过SDS-PAGE进行检测。
1.4.1 间接免疫荧光(IFA)试验 验证蛋白表达。
1.4.2 Western blot试验 进一步验证蛋白表达。
1.4.3 蛋白的纯化 利用琼脂糖珠进行亲和纯化。
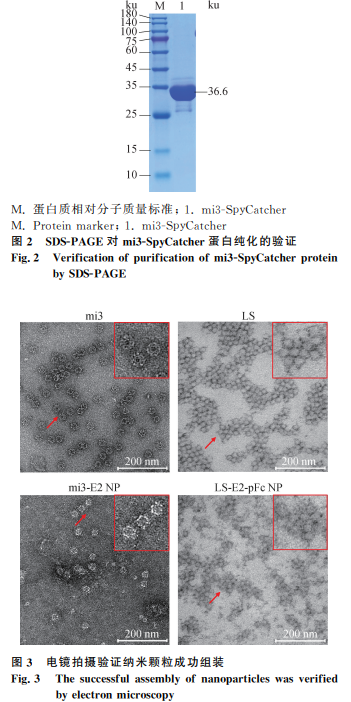
通过透射电镜和动态光散射试验验证纳米颗粒的组装。
1.5.1 透射电镜的观察 观察纳米颗粒的形态和粒径。
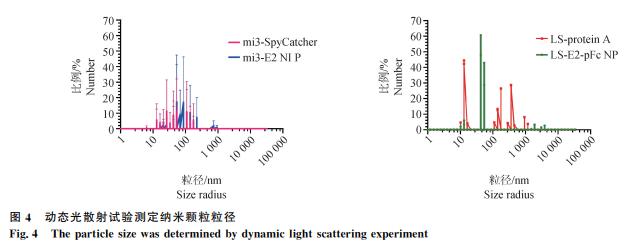
1.5.2 动态光散射试验的验证 测定纳米颗粒的粒径分布。
制备亚单位疫苗并进行免疫保护试验,评估特异性抗体水平、中和抗体水平、体温变化和脾脏病毒载量。
1.6.1 亚单位疫苗的制备 将蛋白与佐剂乳化。
1.6.2 亚单位疫苗的免疫保护试验 对家兔进行免疫和攻毒。
1.6.3 ELISA检测特异性抗体水平 检测血清中特异性抗体。
1.6.4 中和试验检测CSFV中和抗体水平 检测血清中和抗体。
1.6.5 RT-qPCR检测攻毒后脾脏中CSFV病毒载量 检测脾脏中的病毒载量。
使用Graph Pad Prism软件进行显著性分析。
成功表达了E2、SpyTag-E2、E2-pFc和LS-protein A蛋白,纯化后的蛋白条带单一,纯度较高(图1,表2)。
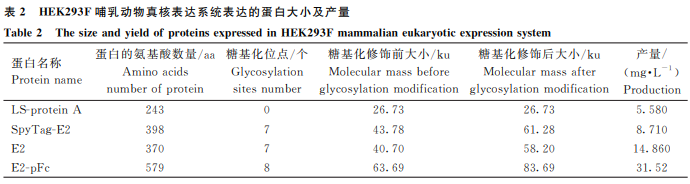
成功表达了mi3-SpyCatcher蛋白,纯化后的蛋白条带单一,产量为9.73 mg·L-1(图2)。
透射电镜观察到粒径在10~70 nm的纳米颗粒(图3)。动态光散射试验显示mi3-E2 NP的平均粒径为68 nm,LS-E2-pFc NP的平均粒径为42.4 nm(图4)。
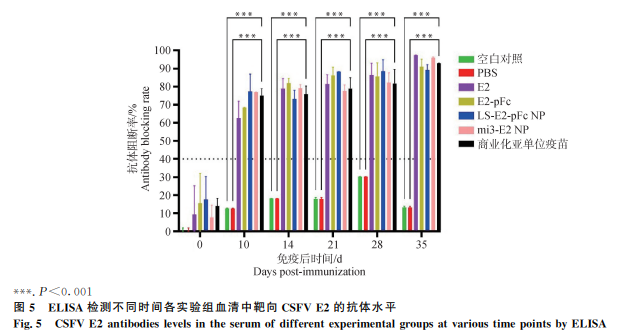
免疫10 d后,mi3-E2 NP和LS-E2-pFc NP的抗体阻断率高于E2组(P<0.01),免疫35 d后各免疫组抗体阻断率均在89%以上(图5)。
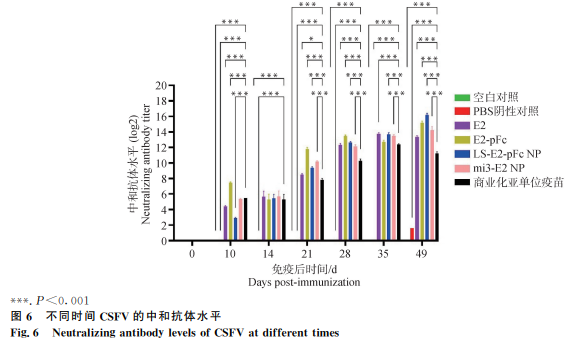
免疫10 d后,E2-pFc组中和抗体水平最高(P<0.001),免疫35 d后LS-E2-pFc NP组中和抗体水平最高(P<0.001)(图6)。
攻毒后,PBS阴性对照组出现典型定型热反应,其余免疫组体温变化不明显(图 7)。
E2组有一只兔检出低拷贝的病毒载量,其余免疫组未检到病毒载量(表3)。

本研究成功制备了猪瘟E2、E2-pFc、mi3-E2 NP和LS-E2-pFc NP纳米疫苗,并通过兔体试验验证了LS-E2-pFc NP在诱导产生中和抗体方面的优势。这种“标记”疫苗可以对自然感染和免疫接种的动物进行鉴别诊断,有助于猪场净化猪瘟。未来需要在猪上进行免疫效果评估,并探索最低免疫剂量,同时考虑如何降低生产成本。
本研究成功制备了猪瘟E2、E2-pFc、mi3-E2 NP和LS-E2-pFc NP纳米疫苗,并通过兔体试验验证了LS-E2-pFc NP在诱导产生中和抗体方面的优势,为猪瘟亚单位疫苗的研究与应用提供了参考。