
《畜牧兽医学报》2025年第56卷第4期刊登了浙江省动物疫病预防控制中心刘爱军, 黄晓兵, 张传亮, 张红丽的文章——“布鲁氏菌与宿主天然免疫信号通路相互作用的研究进展”,该文由
导读
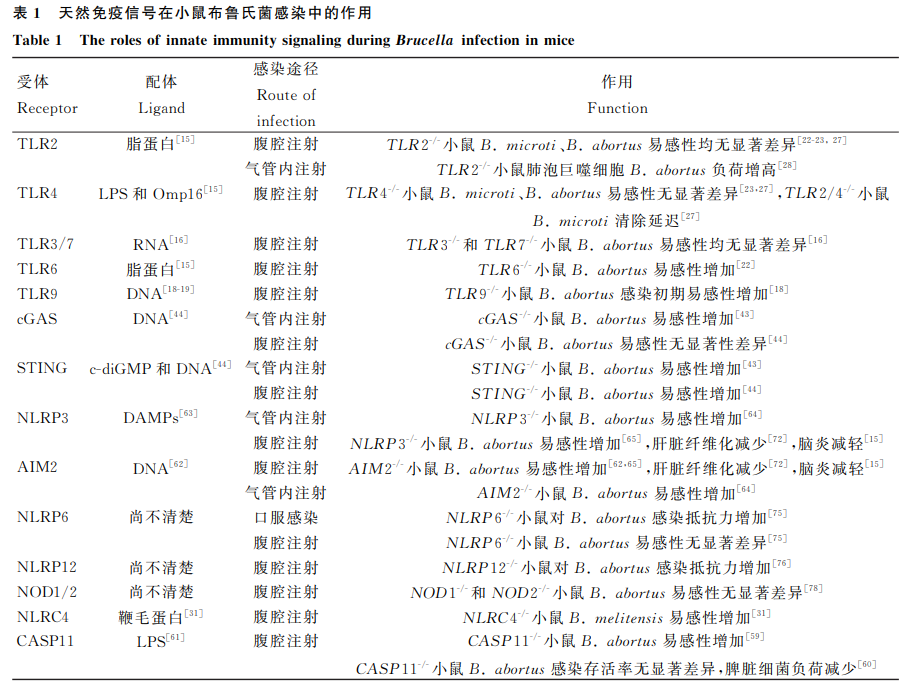
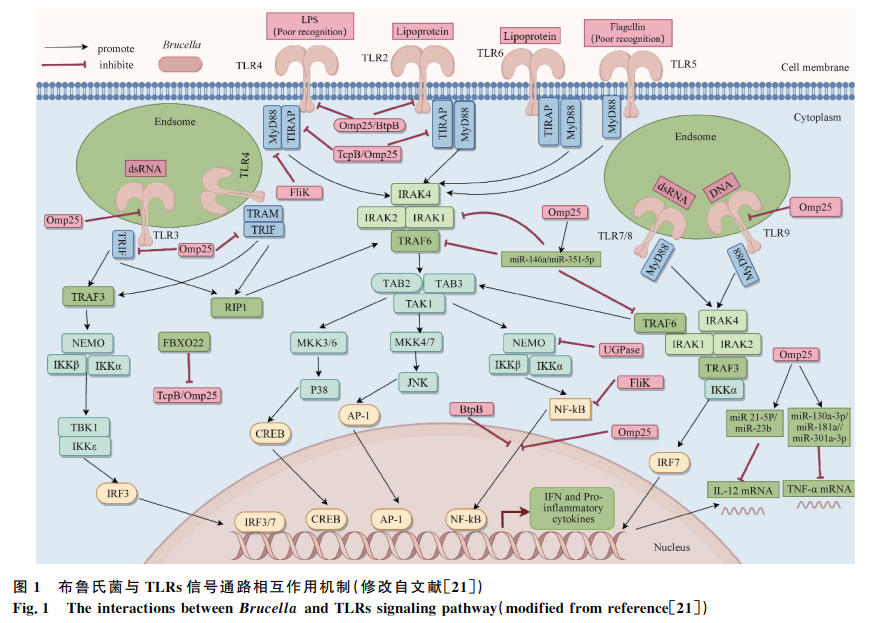
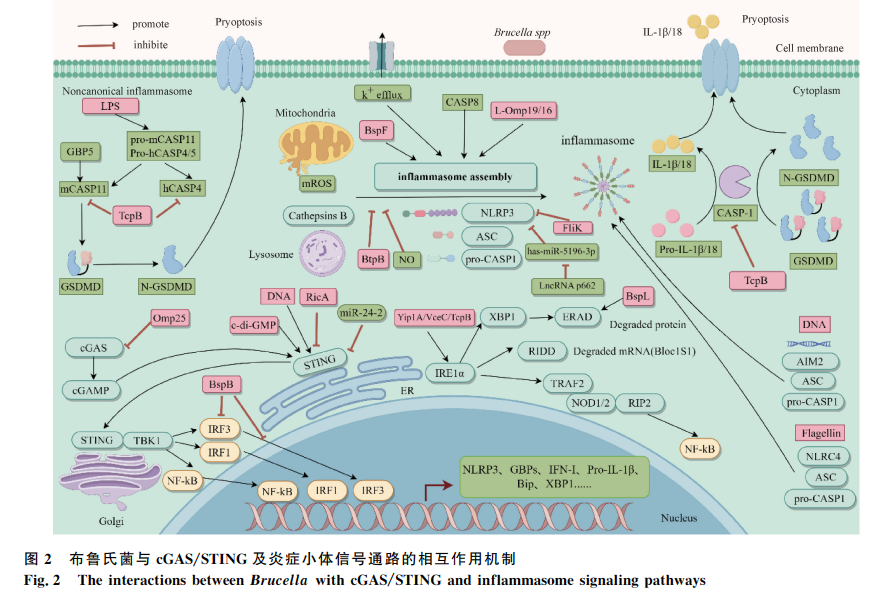
布鲁氏菌病是一种由布鲁氏菌感染引起的全球性人兽共患病,对畜牧业和公共卫生安全构成严重威胁。天然免疫是宿主抵御病原体感染的第一道防线,通过模式识别受体(PRRs)识别病原体相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),激活信号通路,诱导细胞因子和干扰素的产生。布鲁氏菌能够通过多种策略调节天然免疫信号通路,从而建立持续性感染。本文综述了布鲁氏菌与天然免疫信号通路(如TLRs、cGAS/STING、NLRs、AIM2、CLRs和RLRs)的相互作用机制,为研发新型疫苗或药物提供理论依据。多种天然免疫信号通路(包括TLRs、cGAS、STING、NLRs、AIM2等)在小鼠布鲁氏菌感染中的作用,受体、配体、感染途径及作用机制见表1,为后续详细讨论提供了基础数据。
引用本文
刘爱军, 黄晓兵, 张传亮, 张红丽.
LIU Aijun, HUANG Xiaobing, ZHANG Chuanliang, ZHANG Hongli.