
《畜牧兽医学报》2025年第56卷第3刊登了中国农业科学院兰州兽医研究所, 兰州大学动物医学与生物安全学院, 动物疫病防控全国重点实验室张越, 茹毅, 郝荣增, 杨锐, 赵陇和, 李亚军, 杨洋, 张荣, 蒋成辉, 郑海学的文章——“非洲猪瘟病毒H108R蛋白的制备及其免疫原性评价”,该文由国家重点研发计划(2021YFD1801302-3);甘肃省自然科学基金重点项目(23YFNA0011);中央高校基本科研业务费专项(lzujbky-2022-ct02);兰州市青年科技人才创新项目(2023-QN-3);中央级公益性科研院所基本科研业务费专项(CAAS-ZDRW202409);国家生猪产业技术体系(CARS-35);甘肃省科技重大专项(23ZDKA0002) 资助。该研究的创新点在于1)H108R蛋白的原核表达与纯化:首次成功利用原核表达系统制备了非洲猪瘟病毒H108R蛋白,并通过优化纯化工艺获得了具有高纯度和良好抗原性的重组蛋白。2)免疫原性评价:系统评估了H108R蛋白的免疫原性,发现其能够显著激活小鼠脾脏T淋巴细胞,诱导高水平细胞因子产生,并且制备的多克隆抗体具有高效的病毒抑制能力。3)疫苗候选抗原潜力:为H108R蛋白作为非洲猪瘟亚单位疫苗候选抗原的应用提供了重要理论依据,为非洲猪瘟疫苗的研发开辟了新的方向。
导读
非洲猪瘟(ASF)是由非洲猪瘟病毒(ASFV)引起的一种急性、高致死性传染病,对全球养猪业造成了巨大损失。尽管ASFV的研究已有百年历史,但由于其复杂的基因组和对病毒与宿主相互作用机制的了解有限,目前仍未有有效的商品化疫苗和药物可用。本研究旨在制备ASFV的H108R蛋白,并通过免疫小鼠评价其免疫原性,为开发基于H108R蛋白的疫苗提供理论依据。
实验动物:6~8周龄雌性BALB/c小鼠,用于免疫试验。
主要试剂和仪器:包括BL21(DE3)感受态细胞、His标签单克隆抗体、亲和层析柱、流式细胞仪等,用于蛋白表达、纯化、免疫和检测。
通过生物信息学工具分析H108R蛋白的氨基酸组成、理化性质、跨膜区、信号肽以及二级和三级结构。
根据生物信息学分析结果,选择H108R蛋白33~108位氨基酸序列进行串联融合,设计并合成基因序列,插入pET-28a原核表达载体中,构建重组质粒pET-H108R。
将重组质粒转化至大肠杆菌BL21(DE3)中,通过IPTG诱导表达,利用SDS-PAGE和Western blot鉴定蛋白表达形式。
采用尿素变性后的菌体沉淀进行纯化,利用Western blot鉴定纯化后的蛋白 。
将重组H108R蛋白与弗氏佐剂乳化后免疫小鼠,通过间接ELISA检测血清抗体效价。
Western blot检测:验证多克隆抗体对纯化H108R蛋白的特异性识别。
细胞免疫荧光(IFA)试验:检测多克隆抗体与ASFV-GFP感染细胞的反应性 。
通过流式细胞术检测免疫小鼠脾脏中CD4+和CD8+ T淋巴细胞的比例 。
利用ELISA试剂盒检测小鼠血清中IFN-γ、TNF-α、IL-4的含量 。
将H108R多克隆抗体与ASFV-GFP病毒孵育后,观察病毒复制形成的荧光斑点数和病毒基因拷贝数 。
通过对非洲猪瘟病毒H108R蛋白的生物信息学分析,确定了其氨基酸组成、理化性质、跨膜区、信号肽以及二级和三级结构特征:
氨基酸组成 :H108R蛋白由108个氨基酸组成,分子量为12.614 ku,等电点为5.20,整体呈亲水性(表1)。
跨膜区预测 :H108R蛋白的10-32位氨基酸为跨膜区(图1)。
信号肽预测 :H108R蛋白不存在信号肽序列(图2)。
亲疏水性预测 :蛋白的前35个氨基酸疏水性较强,其余区域亲水性较好(图3)。
二级结构预测 :主要包含α螺旋(37.96%)、延伸链(17.59%)和无规则卷曲(36.11%)(图4)。
三级结构预测 :存在较多的α螺旋,与二级结构相似(图5)。
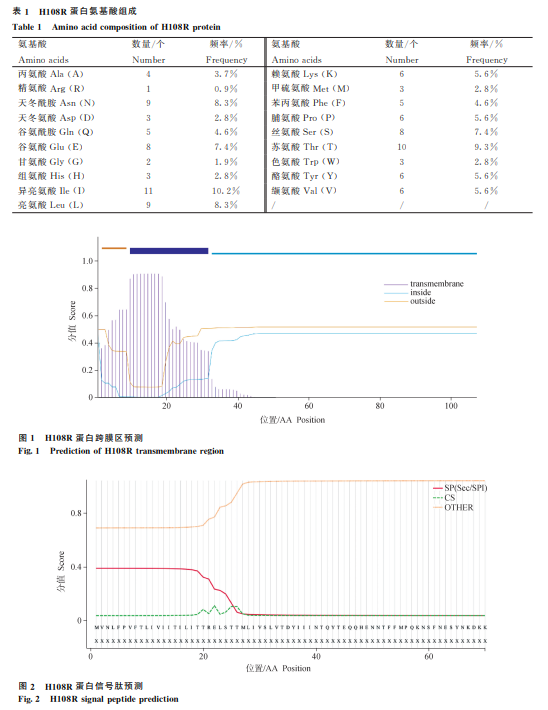
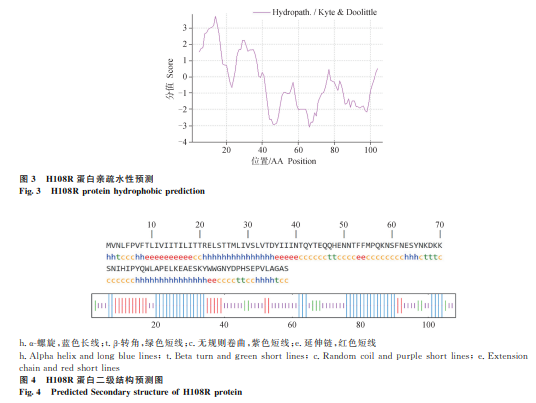
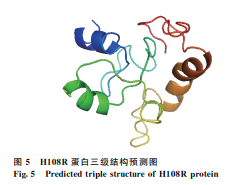
基于以上分析,选择H108R蛋白的33-108位氨基酸序列进行串联融合,用于后续的重组蛋白表达。
重组质粒pET-H108R经过EcoRⅠ和XhoⅠ双酶切后,琼脂糖凝胶电泳显示与预期设计基因大小一致的目标条带(图6),测序结果与设计序列一致,成功构建了含有H108R基因序列的重组质粒。
将重组质粒pET-H108R转化至大肠杆菌BL21(DE3)中,经IPTG诱导表达后,通过SDS-PAGE和Western blot鉴定,结果显示在27 ku左右有一条明显条带,表明重组H108R蛋白主要以包涵体形式存在(图7)。
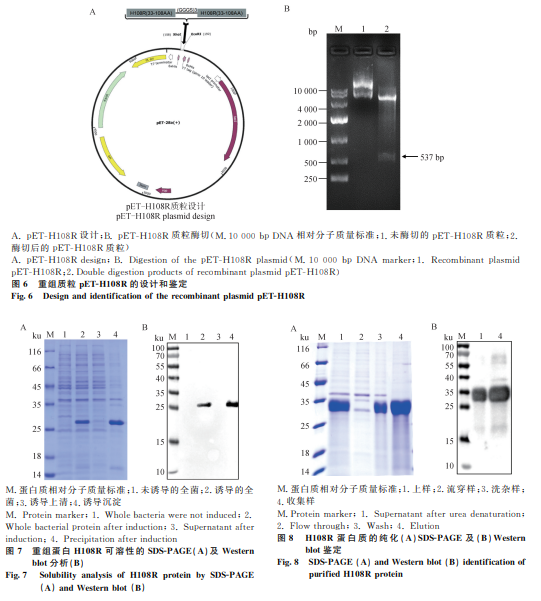
利用尿素变性后的菌体沉淀进行纯化,成功获得重组H108R蛋白。Western blot鉴定显示,纯化后的蛋白在预期目标位置出现特异性条带(图8),表明成功纯化了H108R蛋白。
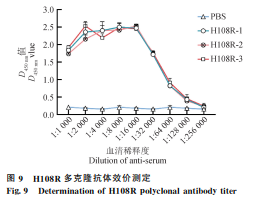
2.5 H108R蛋白多克隆抗体的制备及效价测定
通过间接ELISA检测免疫小鼠血清抗体效价,结果显示,抗体效价可达1∶128 000(图9),表明H108R蛋白具有良好的免疫原性。
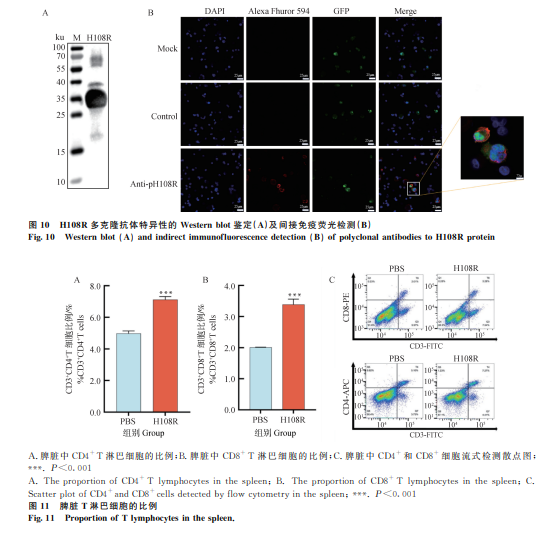
Western blot检测(图10A):多克隆抗体能够特异性识别纯化的H108R蛋白。
细胞免疫荧光(IFA)试验(图10B):与阴性血清相比,H108R多克隆抗体在ASFV-GFP感染细胞中显示出特异性红色荧光,表明抗体与病毒具有良好的反应性。
通过流式细胞术检测免疫小鼠脾中CD4+和CD8+ T淋巴细胞的比例,结果显示H108R蛋白免疫后脾中CD4+和CD8+ T淋巴细胞的比例显著升高(图11),表明该蛋白能够有效诱导细胞免疫应答。
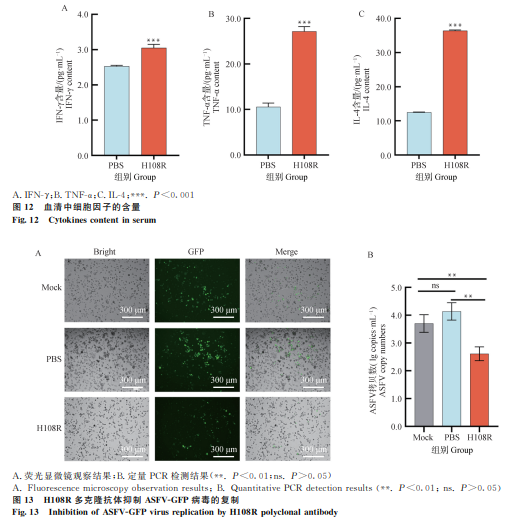
2.8 H108R蛋白能诱导机体产生更高水平的细胞因子
利用ELISA试剂盒检测小鼠血清中IFN-γ、TNF-α、IL-4的含量,结果显示H108R蛋白免疫能够诱导机体产生更高水平的细胞因子(图12),进一步证明了其免疫原性。
将H108R多克隆抗体与ASFV-GFP病毒孵育后,荧光显微镜观察显示病毒复制形成的荧光斑点数显著减少,定量PCR检测显示病毒基因拷贝数更低(图13),表明H108R多克隆抗体能够有效抑制病毒的复制。
3 讨论
本研究通过生物信息学分析和试验验证,成功制备了H108R蛋白,并证明其具有良好的免疫原性。H108R蛋白能够诱导小鼠脾T细胞的活化,刺激机体产生更高水平的细胞因子,且制备的多克隆抗体能够抑制ASFV-GFP病毒的复制。这些结果表明H108R蛋白具有作为亚单位疫苗候选抗原的潜力,为深入研究其生物学功能及疫苗开发奠定了基础。
本研究成功制备了非洲猪瘟病毒H108R蛋白,免疫小鼠后能够诱导脾T细胞的活化,刺激产生更高水平的细胞因子,制备的多克隆抗体能够抑制ASFV-GFP病毒的复制,具有较好的免疫原性。
关键词: